
Указания PIC/S для инспекторов по оценке эффективности системы управления изменениями с учетом риска для качества
21 Января 2022
15 июля 2021 года введены в действие очередные указания схемы взаимодействия конвенции фармацевтических инспекций PIC/S по оценке и демонстрации эффективности фармацевтической системы качества (ФСК) в отношении управления изменениями с учетом риска для качества. Документ PI 054-1 (1) является практическим руководством для инспекторов, осуществляющих оценку соответствия GMP у производителей лекарственных препаратов и активных фармацевтических субстанций, включая лаборатории контроля качества. При разработке документа были учтены сведения, полученные от представителей промышленности.
Для каждого этапа в документе указаны аспекты, которые обеспечивают эффективность ФСК в данной области. Приведенные аспекты соответствуют базовым критериям, которые обычно применяются в процессе управления изменениями, и не вводят новых требований GMP.
Система управления изменениями, основанная на оценке рисков, должна обеспечить своевременное управление рисками для качества продукции и безопасности пациентов, а также привести к улучшению качества и производственных показателей, постоянному совершенствованию и инновациям.
Обзор нормативных требований
В главе 1 правил GMP PIC/S в отношении эффективности ФСК и планируемых изменений говорится следующее:
- Принцип: «… должна существовать «всесторонне разработанная и правильно функционирующая фармацевтическая система качества, включающая в себя правила GMP и принципы управления рисками для качества. Она должна быть оформлена документально, а её эффективность контролироваться».
- пункт 1.3 … «эффективность системы обычно демонстрируется на уровне производственной площадки».
- пункт 1.5 «Высшее руководство несёт основную ответственность за наличие эффективной фармацевтической системы качества …».
- пункт 1.4 (xii) Должны предприниматься меры «для перспективной оценки запланированных изменений и их утверждения перед внедрением …».
Дополнительно, в Приложении 15 GMP PIC/S в отношении управления изменениями говорится следующее:
- пункт 11.1. «Контроль изменений является важной частью управления знаниями и должен осуществляться в рамках фармацевтической системы качества».
- пункт 11.4. «Управление рисками для качества должно использоваться для оценки запланированных изменений … и для планирования любых необходимых мероприятий по валидации, верификации или повторной квалификации процесса».
- пункт 11.7. «… должна быть проведена оценка эффективности изменений …».
Указания по демонстрации и оценке эффективности системы управления изменениями с учетом риска для качества
Документ PI 054-1 охватывает все значимые этапы процесса управления изменениями:
- инициацию изменений,
- оценку изменений,
- планирование и внедрение изменений,
- анализ изменений и
- проверку эффективности.
Представленный ниже перечень рекомендуется использовать производителям в качестве руководства для составления своих внутренних процедур (СОП) по управлению изменениями и инспекторам для оценки соответствия GMP в данной области.
1. Инициация изменений
Ниже перечислены ключевые моменты, которые необходимо учитывать при оценке необходимости и/или целесообразности изменений:
- Причины для изменений и их основания четко документально оформляются. Общие факторы жизненного цикла, приводящие к необходимости изменений, включают следующие обстоятельства, но не ограничиваются ими:
- постановка на производство новой продукции;
- модернизация оборудования или аппаратурного оснащения, включая компьютеризированные системы, или изменения, направленные на улучшение способности к обнаружению на предшествующих стадиях производства (например, комплексный мониторинг и/или тестирование);
- изменение сырья и/или упаковочных материалах или их поставщиков;
изменения в методиках аналитических испытаний; - изменения, связанные с улучшением производственных показателей и стабильности (для снижения вариабельности и т.п.);
- увеличение производственных мощностей (масштабирование);
устранение проблем качества; - устранение проблем ФСК, например: отклонений, претензий/неблагоприятных событий, нарушений соответствия, реализация корректирующих и предупреждающих действий, показателей (индикаторов) эффективности, заключений по годовым обзорам качества, анализу со стороны руководства;
новые или обновленные нормативные требования, методические указания, политики, процедуры и т.п.; - внедрение инноваций или проектов по непрерывному совершенствованию, включая предложения о производстве с минимальными затратами для исключения потерь.
- Система управления изменениями обеспечивает своевременное внесение предложений о необходимости изменений, официальную оценку требуемых изменений и документальное оформление решения о принятии или отклонении предложений на изменения. В отношении отклоненных/непринятых предложений об изменениях, особенно тех, которые связаны со снижением риска для качества/безопасности/эффективности/соответствия, система обеспечивает документальное оформление и обоснование таких решений, а также надлежащее управление сохраняющимися рисками.
- Цели, область применения, прогнозируемые результаты и ожидаемые преимущества предлагаемого изменения документально оформляются.
- Возможное воздействие предлагаемого изменения на другую продукцию, процессы, системы или производственные участки объективно оценивается и надлежащим образом документально оформляется.
- Рассматриваются возможные последствия предлагаемого изменения на другие предложения по изменениям, которые могут внедряться в то же самое время, и осуществляется соответствующее управление рисками, связанными с совокупным действием многочисленных предложений по изменениям.
- В разработке и утверждении предложений по изменениям участвуют профильные эксперты и соответствующие внутренние и/или внешние заинтересованные стороны, например заказчики продукции, отдел обеспечения качества, другие вовлеченные подразделения.
- Учитывается потенциальное влияние на рассматриваемые/утвержденные документы и взятые обязательства, в том числе по соблюдению нормативных требований.
2. Оценка риска, связанного с изменениями
Процедуры управления изменениями часто требуют классифицировать предлагаемые изменения на основе рисков (например, критические, основные (существенные), незначительные), а также проводить оценку воздействия, под которой обычно понимается оценка возможного влияния предлагаемого изменения на различные элементы: качество продукции, документацию, очистку, техническое обслуживание, соответствие нормативным требованиям и т.п. В некоторых случаях, особенно для простых и незначительных изменений с низким уровнем риска, для документального обоснования изменения бывает достаточно только оценки воздействия с учётом рисков без использования официальных инструментов или подходов к оценке рисков.
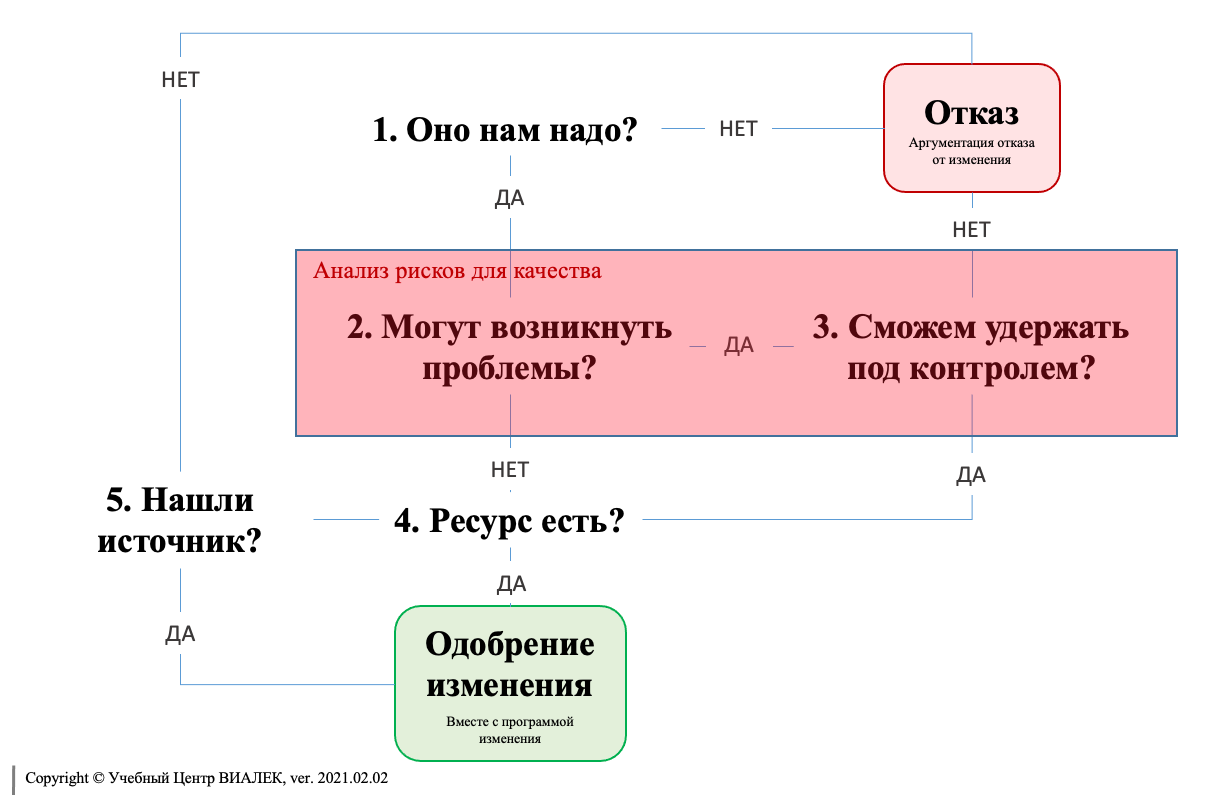
Более официальная оценка рисков должна применяться к предложениям по изменениям, которые предполагают более сложные или значительные (например, крупные, критические) изменения. Такая оценка рисков должна более детально рассматривать возможные негативные последствия от предлагаемого изменения, а также потенциальное воздействие данного изменения на основе знаний о текущем производственном процессе и жизненном цикле продукции/оборудования.
По возможности изменения должны снижать риски качества для продукции и/или угрозы безопасности пациентов до приемлемого уровня. Как минимум изменения должны поддерживать или улучшать качество продукции и/или уровень безопасности для пациентов и не должны приводить к увеличению вариабельности производственного процесса.
Система управления изменениями должна включать проведение и документальное оформление соответствующей оценки рисков на основе научных данных и знаний с учётом приведённых ниже условий:
- Официальный уровень рассмотрения, предполагаемые мероприятия (например, тестирование, валидация, пересмотр) и объём документации соизмерим с уровнем риска.
- Оценка рисков в полной мере учитывает потенциальные риски и возможности от изменений для качества продукции, безопасности и эффективности.
- Оценка рисков всесторонне определяет потенциальные риски и преимущества для другой продукции, процессов и систем.
- При оценке рисков определяются и документально фиксируются как существующие, так и требуемые меры минимизации рисков.
- Изменения и их риски оцениваются с применением современных знаний о продукции и процессе. Для обеспечения такой оценки рисков используются соответствующие данные и информация, а если необходимо, осуществляется их поиск.
- Классифицирование и любые заранее определённые подходы, которые используются для классификации, основаны на уровне рисков и соответствуют ему.
3. Планирование и реализация изменений
На данном этапе обеспечивается:
- Результаты оценки рисков и установленные уровни рисков определяют уровень планирования изменений, расстановку приоритетов, внедрение и сроки их реализации.
- Данные, необходимые для демонстрации эффективного внедрения изменений, а также критерии приемлемости и критерии эффективности изменений предварительно определяются при планировании изменений. Они могут включать такие положения, как частый отбор образцов, продолжающуюся верификацию процесса и статистическую обработку данных (например, расчет Cpk/Ppk), которые способствуют количественной оценке рисков.
- Потенциальные риски на момент до внедрения изменений и любые риски, которые могут появиться в процессе изменений, всесторонне оцениваются.
- При необходимости определяются и своевременно внедряются временные инструменты контроля (краткосрочные меры) для мониторинга/минимизации рисков, связанных с текущей ситуацией (до внедрения изменений).
- Установленные меры контроля рисков своевременно реализуются надлежащим образом.
- Обеспечивается документальное оформление подтверждения внедрения изменений.
- Ранее проведенная оценка рисков пересматривается и обновляется после внедрения изменений.
- При необходимости в документацию вносятся своевременные обновления с учетом соответствующих требований.
- Организовано необходимое взаимодействие с держателями регистрационных удостоверений на лекарственные средства или другими сторонами в связи с внесёнными изменениями.
4. Обзор изменений и эффективности
До внедрения изменений:
- Изменения соответствуют поставленным целям и заранее определённым критериям приемлемости и эффективности. Любые отклонения от этих критериев должным образом оцениваются, рассматриваются и обосновываются, либо определяются последующие меры. По возможности используются количественные данные для объективного определения эффективности изменений (например, статистическая достоверность и охват).
- В рамках мероприятий по управлению рисками для качества осуществляется оценка остаточных рисков и их снижение до приемлемого уровня, а также проводится соответствующая доработка процедур и инструментов контроля.
- Любые непредвиденные последствия или риски, возникшие в результате внедрения изменений, должным образом оцениваются, документируются, минимизируются или принимаются и подлежат контролю в заранее установленные сроки.
До или после внедрения изменений:
- Любые необходимые мероприятия после внедрения изменений, включая меры в отношении отклонений от предварительно установленных критериев приемлемости и/или корректирующих и предупреждающих действий, определены и надлежащим образом выполнены.
- Ранее проведенная оценка рисков обновляется после оценки эффективности. Новые данные о продукции/процессе, полученные в результате оценки рисков и в ходе деятельности по управлению изменениями, фиксируются в соответствующих документах по качеству и производству, например, в стандартных операционных процедурах, отчётах, документах, отражающих стратегию контроля продукции.
- Изменения отслеживаются с помощью систем постоянного мониторинга для поддержания непрерывного контроля, а полученная информация фиксируется и передаётся/обсуждается. (Примечание. В этом отношении могут быть полезны такие мероприятия, как анализ со стороны руководства, ежегодный обзор качества продукции, продолжающаяся верификация процесса, управление отклонениями и мониторинг претензий).
Заключение
Соблюдение указаний, представленных в PI 054-1, будет служить достаточным доказательством наличия эффективной системы управления изменениями, основанной на научных данных и оценке рисков. Во всех случаях, где это возможно, данная система должна способствовать снижению рисков для обеспечения более высоких показателей качества, производственных показателей, постоянного совершенствования и инноваций, посредством надлежащего и своевременного управления рисками для качества продукции и обеспечения безопасности пациентов.
Эффективное управление изменениями важно не только в контексте вышеупомянутых требований GMP PIC/S, но и в контексте ICH Q10, который устанавливает возможность осуществления ослабленного надзора со стороны уполномоченных органов для производителей, демонстрирующих наличие эффективной ФСК. Дополнительно, высокий уровень управления изменениями может способствовать получению максимальных преимуществ от большей гибкости в регулировании послерегистрационных изменений, вносимых в материалы регистрационного досье, обсуждаемой в ICH Q12.
1. PIC/S Recomendation How to Evaluate and Demonstrate the Effectiveness of a Pharmaceutical Quality System in relation to Risk-based Change Management
PrintНаши новости
-
10 октября - Всемирный день психического здоровья
10 Октября 2024
-
Игра «вдолгую»: эксперты компании «НоваМедика» на отраслевой конференции по маркетингу
10 Октября 2024
-
НоваМедика в рейтинге «ТОП-1000 российских менеджеров 2024»
28 Сентября 2024
Медиа-центр
-
БРИКС усиливает сотрудничество в разработке вакцин и ядерной медицине
29 Октября 2024
-
ФАС и Минздрав разъяснили порядок определения НМЦК при закупках препаратов
29 Октября 2024
-
Завершен первый этап КИ нового российского препарата против рака
28 Октября 2024
-
Петербургский химфармуниверситет начнет выпуск собственных лекарств
28 Октября 2024