
Количество разрешений на международные клинические исследования сократилось в два раза
28 Июня 2022
Во II квартале 2022 года выдано 36 разрешений на проведение международных многоцентровых клинических исследований. За этот же период прошлого года – 75 разрешений. При этом резко выросло количество одобрений проведения биоэквивалентности российскими компаниями.
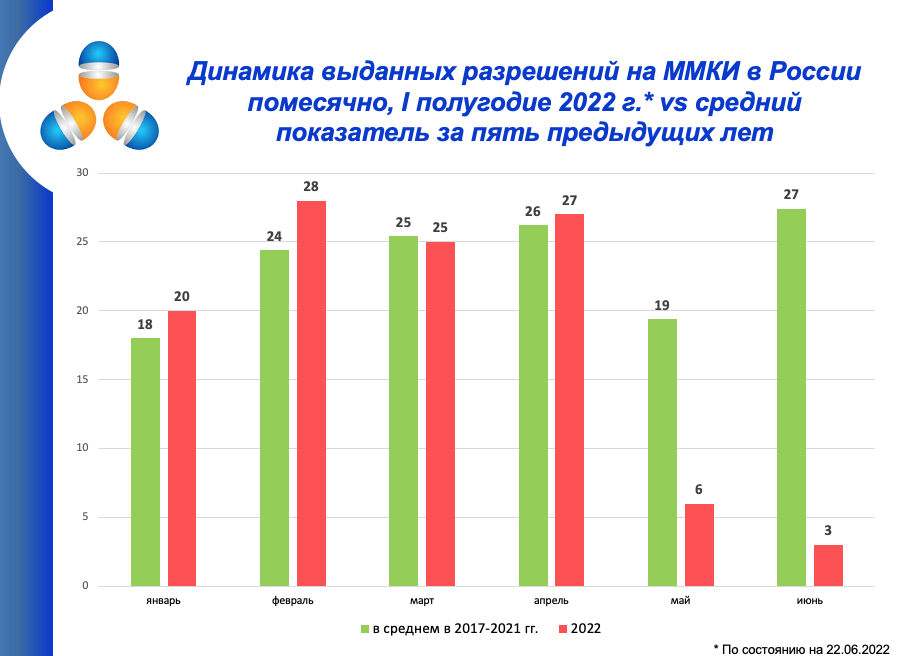
Рынок международных клинических исследований резко сократился в 2022 году. В мае на такие исследования выдано шесть разрешений, а средний показатель за предыдущие годы средний был 19, с 1 по 22 июня 2022 года было всего три одобрения, средний показатель за июнь – 27. Об этом на встрече с логистами, организованной компанией Corex, рассказала директор Ассоциации организации по клиническим исследованиям (АОКИ) Светлана Завидова.
Ситуация с международными исследованиями
В I квартале 2022 года количество разрешений на ММКИ практически соответствовало прошлому году: 73 и 78 одобрений соответственно. Во втором квартале ситуация изменилась: 36 разрешений на ММКИ выдано в 2022 году, 75 – в 2021-ом. Итого за шесть месяцев 2022 года 109 разрешений против 153 в прошлом году.
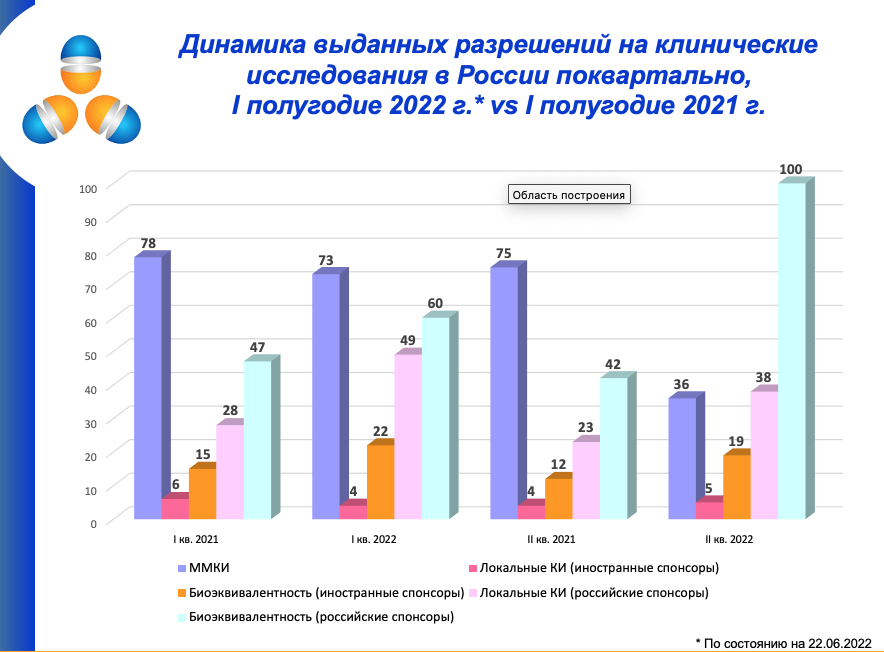
Завидова пояснила, что к ММКИ АОКИ относит исследования иностранных компаний, которые также фигурируют в западных реестрах клинисследований. В госреестре лекарственных средств к ММКИ могут быть отнесены КИ, которые проводятся, например, только в России и Белоруссии.
По мнению эксперта, бигфарма потеряла много пациентов, участвующих в клинических исследованиях, причем на двух крупных рынках – России и Украине. АОКИ со ссылкой на портал clinicaltrials.gov приводит данные, что на 21 июня 2022 года в России насчитывалось 1 414 активных интервенционных КИ, на Украине – 611.

Завидова полагает, решение о приостановке клинических исследований скорее связано не политическое, а рациональное, так как в нестабильной ситуации проводить исследования, которые длятся 5-10 лет, рискованно. Сейчас многие компании решают как им поступить дальше, изучают возможность расширить свою деятельность в сопредельных странах.
Российские исследования
Одновременно с сокращением ММКИ резко выросло количество одобрений на исследования российских компаний. Больше всего разрешений выдано на проведение исследований биоэквивалентности – 160 за первое полугодие, в 2021 году было всего 89. Также с 51 с 2021 году до 87 в 2022 году выросло количество разрешений на полные клинические исследования, выданным российским компаниям.
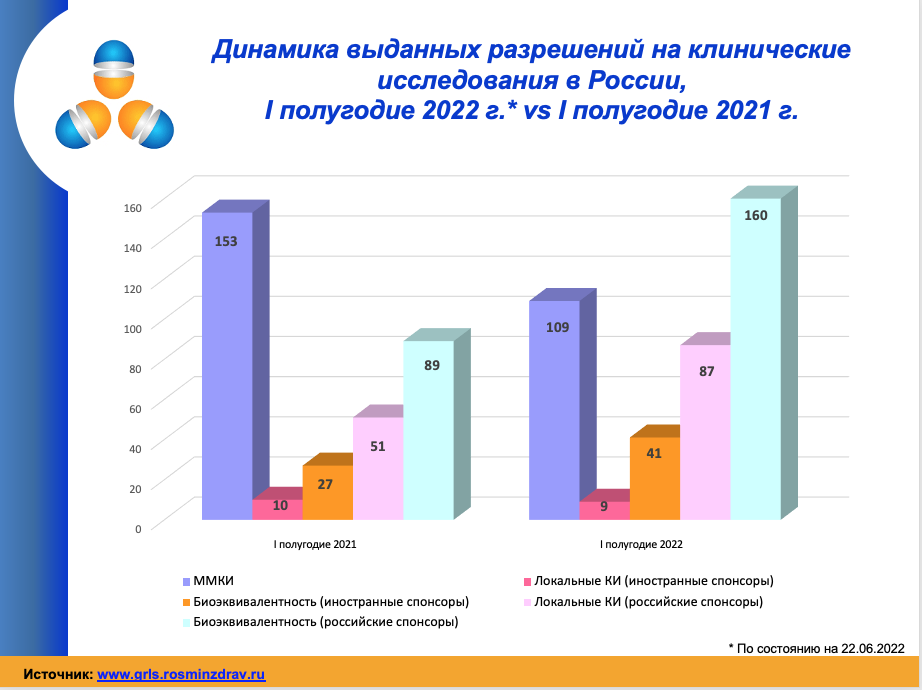
«По нашей предварительной оценке, такой всплеск можно объяснить большим количеством противоковидных препаратов. Кроме того пока не известно, сколько разрешений будут действительно реализованы», – отметила Завидова.
Директор по развитию «Экзактэ Лабс» Екатерина Максимова подтвердила, наличие всплеска спроса со стороны российской фармы на проведение исследование на биоэквивалентность. Специалисты компании отметили, что большая проблема может быть с референсными образцами. Часть поставщиков перестали их привозить в Россию, некоторые пока не настроили новые логистические цепочки. Большие надежды они возлагают на намерение правительства создать отечественных банк образцов.
В то же время, по мнению Директора по качеству Corex Logistic Виталия Шахназарова, референсные образцы еще долго будут ввозиться в Россию, поскольку на создание базы может уйти до десяти лет. В этой связи, он полагает, можно было бы расширить список параллельного импорта для ввоза стандартных образцов, реагентов, определенного вида оборудования.
PrintНаши новости
Медиа-центр
-
Поздравляем с Новым годом и Рождеством!
28 Декабря 2024
-
Елена Литвинова: «GxP-Профи» cоздан для стимулирования и масштабирования лучших практик»
27 Декабря 2024
-
«НоваМедика» и ЕАНП разработали обучающий курс по контролю качества твердых лекарственных форм
24 Декабря 2024
-
НоваМедика в программе «Пять минут о московской промышленности»
19 Декабря 2024